Malnutriția acută la copii: fiziopatologie, efecte clinice și tratament
Malnutriția acută este o deficiență nutrițională rezultată fie dintr-un aport inadecvat de energie, fie de proteine. Copiii cu malnutriție acută primară sunt frecvenți în țările în curs de dezvoltare, ca urmare a aprovizionării insuficiente cu alimente, cauzată de factori sociali, economici și de mediu. Malnutriția acută secundară se datorează de obicei unei boli subiacente care provoacă pierderi anormale de nutrienți, creșterea cheltuielilor energetice sau scăderea aportului alimentar. Malnutriția acută duce la modificări biochimice bazate pe mecanisme metabolice, hormonale și glucoreglatoare. Majoritatea copiilor cu malnutriție acută primară pot fi gestionați acasă cu intervenții specifice nutriției (de exemplu, consilierea părinților, asigurarea securității alimentare a gospodăriei etc.). În caz de malnutriție acută severă și complicații, se recomandă tratamentul cu internare. Malnutriția acută secundară trebuie gestionată prin tratarea cauzei subiacente.
Introducere
Malnutriția acută este o deficiență nutrițională rezultată fie dintr-un aport inadecvat de proteine, fie dintr-un aport energetic. În 1959, Jelliffe a introdus termenul „malnutriție proteică-calorică”, care a fost înlocuit cu „malnutriție acută”. Olsen și colab. [1] au definit malnutriția proteică-energetică ca fiind privarea nutrițională în rândul copiilor din țările în curs de dezvoltare. Toți termenii, însă, se referă la subnutriția pediatrică ca la o stare de nutriție în care deficitul de energie, proteine și alți nutrienți duce la efecte adverse măsurabile asupra funcțiilor țesuturilor și organismului și la un rezultat clinic de deviere a creșterii [2]. Conform Societății Americane de Nutriție Parenterală și Enterală (ASPEN) [3], malnutriția pediatrică este definită ca „un dezechilibru între necesarul și aportul de nutrienți, rezultând deficite cumulative de energie, proteine sau micronutrienți care pot afecta negativ creșterea, dezvoltarea și alte rezultate relevante”.
Pe baza etiologiei sale, malnutriția este fie legată de o boală (una sau mai multe boli sau leziuni duc direct la un dezechilibru nutrițional), fie cauzată de factori de mediu/comportamentali asociați cu un aport și/sau o livrare scăzute de nutrienți. Malnutriția acută primară la copii este rezultatul unei aprovizionări alimentare inadecvate cauzate de factori socioeconomici, politici și de mediu și este cel mai frecvent întâlnită în țările cu venituri mici și medii [4,5]. Factorii responsabili includ insecuritatea alimentară a gospodăriilor, sărăcia, nutriția deficitară a femeilor însărcinate, restricția de creștere intrauterină, greutatea mică la naștere, alăptarea deficitară și alimentația complementară inadecvată, bolile infecțioase frecvente, calitatea slabă a apei, igiena etc. Prin urmare, malnutriția acută primară este în mare parte de origine socială, mai degrabă decât biomedicală, dar este și multifactorială. De exemplu, se crede din ce în ce mai mult că calitatea slabă a apei, salubritatea și practicile de igienă sunt cauza afecțiunii numite „enteropatie de mediu” care contribuie la malnutriția acută în copilărie [6]. Expunerea repetată la agenți patogeni din mediu provoacă colonizarea bacteriană a intestinului subțire, cu acumularea de celule inflamatorii în mucoasa intestinului subțire, deteriorarea vilozităților intestinale și, în consecință, malabsorbția nutrienților, ceea ce duce la malnutriție.
Malnutriția acută secundară se datorează de obicei pierderilor anormale de nutrienți, creșterii cheltuielilor energetice sau scăderii aportului alimentar, frecvent în contextul unor boli subiacente, în mare parte cronice, precum fibroza chistică, insuficiența renală cronică, bolile hepatice cronice, malignitățile infantile, cardiopatiile congenitale și bolile neuromusculare [4,5].
Deși poate exista o lipsă de consens cu privire la utilizarea terminologiei și a definiției, există un consens asupra faptului că malnutriția acută ar trebui diagnosticată doar folosind parametri antropometrici.
Scopul acestei analize este de a descrie fiziopatologia și principalele aspecte clinice ale malnutriției acute în copilărie și de a oferi o imagine de ansamblu asupra recomandărilor actuale privind gestionarea, bazate pe tipul, cauza și severitatea malnutriției acute.
Epidemiologie
Malnutriția acută este responsabilă pentru aproape o treime din totalul deceselor la copiii cu vârsta <5 ani și provoacă deficiențe intelectuale sau cognitive în rândul celor care supraviețuiesc [5]. Numărul estimat de copii subponderali (scor Z greutate-vârstă < -2) la nivel global este de 101 milioane sau 16%. Prevalența malnutriției acute și severe în rândul copiilor sub 5 ani depășește obiectivul Adunării Mondiale a Sănătății de a reduce și menține prevalența sub 5% până în 2025.
În studiile care utilizează diverse metode de evaluare a malnutriției, prevalența malnutriției acute în rândul copiilor spitalizați din țările dezvoltate a variat de la 6 la 51% [8,9,10,11,12]. În 2008, Pawellek și colab. [11], utilizând criteriile Waterlow, s-a raportat că 24,1% dintre pacienții pediatrici dintr-un spital terțiar din Germania sufereau de malnutriție, dintre care 17,9% aveau malnutriție ușoară, 4,4% moderată și 1,7% severă. Prevalența malnutriției a variat în funcție de afecțiunea medicală de bază și a variat de la 40% în cazul bolilor neurologice, la 34,5% pentru bolile infecțioase, 33,3% pentru fibroza chistică, 28,6% pentru bolile cardiovasculare, 27,3% pentru pacienții oncologici și 23,6% în cazul bolilor gastrointestinale [11]. Pacienții cu diagnostice multiple erau cel mai predispuși la malnutriție (43,8%). În ciuda diferențelor în măsurătorile malnutriției, aceste studii documentează în mod clar o prevalență semnificativă a malnutriției chiar și în lumea dezvoltată [4].
Fiziopatologie
Aportul energetic inadecvat duce la diverse adaptări fiziologice, inclusiv restricție de creștere, pierdere de grăsime, masă musculară și viscerală, rată metabolică bazală redusă și cheltuieli energetice totale reduse [4,5,6]. Modificările biochimice în malnutriția acută implică mecanisme metabolice, hormonale și glucoreglatoare. Principalii hormoni afectați sunt hormonii tiroidieni, insulina și hormonul de creștere (GH). Modificările includ niveluri reduse de triiodotiroxină (T3), insulină, factor de creștere asemănător insulinei-1 (IGF-1) și niveluri crescute de GH și cortizol [4]. Nivelurile de glucoză sunt adesea inițial scăzute, cu epuizarea rezervelor de glicogen. În faza incipientă există o gluconeogeneză rapidă, cu pierderea rezultată a mușchilor scheletici cauzată de utilizarea aminoacizilor, piruvatului și lactatului. Ulterior, există faza de conservare a proteinelor, mobilizarea grăsimilor ducând la lipoliză și cetogeneză [13,14,15].
Modificările majore ale electroliților, inclusiv retenția de sodiu și epuizarea intracelulară a potasiului, pot fi explicate prin scăderea activității pompei de sodiu dependente de energie, sensibile la glicozide, care duce la creșterea permeabilității membranelor celulare în kwashiorkor [15].
Sistemele de organe sunt afectate variabil în malnutriția acută [4,15]. Imunitatea celulară este afectată din cauza atrofiei timusului, ganglionilor limfatici și amigdalelor. Există un cluster de diferențiere (CD) 4 redus cu limfocite CD8-T normale, pierderea hipersensibilității întârziate, fagocitoză afectată și imunoglobulină A secretorie redusă. În consecință, susceptibilitatea la infecții invazive (infecții urinare, gastrointestinale, septicemie etc.) este crescută [15,16].
Atrofia viloasă cu pierderea rezultată a dizaharidazelor, hipoplazia criptelor și alterarea permeabilității intestinale duce la malabsorbție. Alte aspecte comune sunt creșterea excesivă a bacteriilor și atrofia pancreatică, rezultând în malabsorbție a grăsimilor; infiltrarea grăsimeasă a ficatului este, de asemenea, frecventă [4]. Metabolismul medicamentelor poate fi scăzut din cauza scăderii albuminei plasmatice și a scăderii fracțiunilor glicoproteinei responsabile de legarea medicamentelor [17].
Miofibrilele cardiace sunt subțiate, cu contractilitate afectată. Debitul cardiac este redus proporțional cu pierderea în greutate. Bradicardia și hipotensiunea arterială sunt, de asemenea, frecvente în cazurile severe [4,16]. Combinația dintre bradicardie, contractilitate cardiacă afectată și dezechilibre electrolitice predispune la aritmii. Masa musculară toracică redusă, rata metabolică scăzută și dezechilibrele electrolitice (hipokaliemie și hipofosfatemie) pot duce la scăderea ventilației minute și la afectarea răspunsului ventilator la hipoxie [4,16,18].
Malnutriția acută a fost recunoscută ca fiind cauza reducerii numărului de neuroni, sinapse, arborizații dendritice și mielinizări, toate acestea rezultând în scăderea dimensiunii creierului [19]. Cortexul cerebral este subțiat, iar creșterea creierului este încetinită. Întârzierile în funcția globală, funcția motorie și memoria au fost asociate cu malnutriția [19]. Efectele asupra creierului în curs de dezvoltare pot fi ireversibile după vârsta de 3-4 ani [5].
Sindromuri clinice
Malnutriția acută se referă la un grup de tulburări corelate care include kwashiorkor, marasmus și stări intermediare de kwashiorkor marasmic. Acestea se disting pe baza constatărilor clinice, principala distincție dintre kwashiorkor și marasmus fiind prezența edemului în kwashiorkor [16].
Marasmus Termenul „marasmus” este dedus din cuvântul grecesc „marasmus”, corelându-se cu atrofierea sau ofilirea. Marasmusul este cel mai frecvent sindrom de malnutriție acută [4]. Se datorează aportului energetic inadecvat pe o perioadă de luni până la ani. Rezultă din răspunsul adaptiv fiziologic al organismului la înfometare, ca răspuns la privarea severă de energie și a tuturor nutrienților și se caracterizează prin atrofierea țesuturilor corporale, în special a mușchilor și a grăsimii subcutanate, fiind de obicei rezultatul unor restricții severe în aportul energetic. Copiii cu vârsta sub cinci ani sunt cei mai frecvent implicați din cauza nevoilor calorice crescute și a susceptibilității crescute la infecții [15]. Acești copii apar emaciați, slabi și letargici și prezintă bradicardie, hipotensiune arterială și hipotermie asociate. Pielea lor este xerotică, ridată și laxă din cauza pierderii de grăsime subcutanată, dar nu este caracterizată de nicio dermatoză specifică [4]. Atrofia musculară începe adesea la nivelul axilei și inghinale (gradul I), apoi la nivelul coapselor și feselor (gradul II), urmată de piept și abdomen (gradul III) și, în final, la nivelul mușchilor faciali (gradul IV), care sunt mai puțin activi metabolic. În cazurile severe, pierderea pernuțelor de grăsime bucală conferă copiilor un aspect facial îmbătrânit. Copiii grav afectați sunt adesea apatici, dar devin iritabili și dificil de consolat [4].
Kwashiorkor
Termenul „kwashiorkor” derivă din limba kwa din Ghana, iar semnificația sa este echivalentă cu „boala înțărcării” [15]. Cicely D. Williams a folosit termenul pentru prima dată în 1933. Se crede că kwashiorkor este rezultatul unui aport caloric inadecvat de proteine, dar rezonabil de normal. A fost raportat pentru prima dată la copiii cu diete bazate pe porumb (acești copii au fost numiți „sugar baby”, deoarece dieta lor este de obicei săracă în proteine, dar bogată în carbohidrați) [4,15]. Kwashiorkor este frecvent în țările în curs de dezvoltare și afectează în principal sugarii mai mari și copiii mici. Apare mai ales în zonele cu foamete sau cu aprovizionare limitată cu alimente și, în special, în acele țări în care dieta constă în principal din porumb, orez și fasole [20]. Kwashiorkor reprezintă un răspuns maladaptativ la înfometare. Edemul este caracteristica distinctivă a kwashiorkorului, care nu există în marasm [21] și rezultă de obicei dintr-o combinație de albumină serică scăzută, cortizol crescut și incapacitatea de a activa hormonul antidiuretic. De obicei, începe ca edem pedal (gradul I), apoi edem facial (gradul II), edem paraspinal și toracic (gradul III) până la asocierea cu ascită (gradul IV). Pe lângă edem, caracteristicile clinice sunt greutate aproape normală pentru vârstă, dermatoze, păr hipopigmentat, abdomen umflat și hepatomegalie. Părul este de obicei uscat, rar, fragil și depigmentat, având o culoare galben-roșiatică. Manifestările cutanate sunt caracteristice și progresează în decurs de zile de la pielea atrofică uscată cu zone confluente de hiperkeratoză și hiperpigmentare, care apoi se despică la întindere, rezultând eroziuni și piele eritematoasă subiacentă [4]. Diverse modificări ale pielii la copiii cu kwashiorkor includ piele lucioasă, cu aspect lăcuit (64%), macule eritematoase pigmentate închise la culoare (48%), piele xerotică cu aspect de pavaj (28%), hipopigmentare reziduală (18%) și hiperpigmentare și eritem (11%) [4].
Kwashiorkor marasmic
Kwashiorkorul marasmic este reprezentat de caracteristici mixte atât ale marasmului, cât și ale kwashiorkorului. În mod caracteristic, copiii cu kwashiorkor marasmic prezintă concomitent atrofie macroscopică și edeme. De obicei, au manifestări cutanate și capilare ușoare și o ficat gras palpabil mărit.
Evaluare
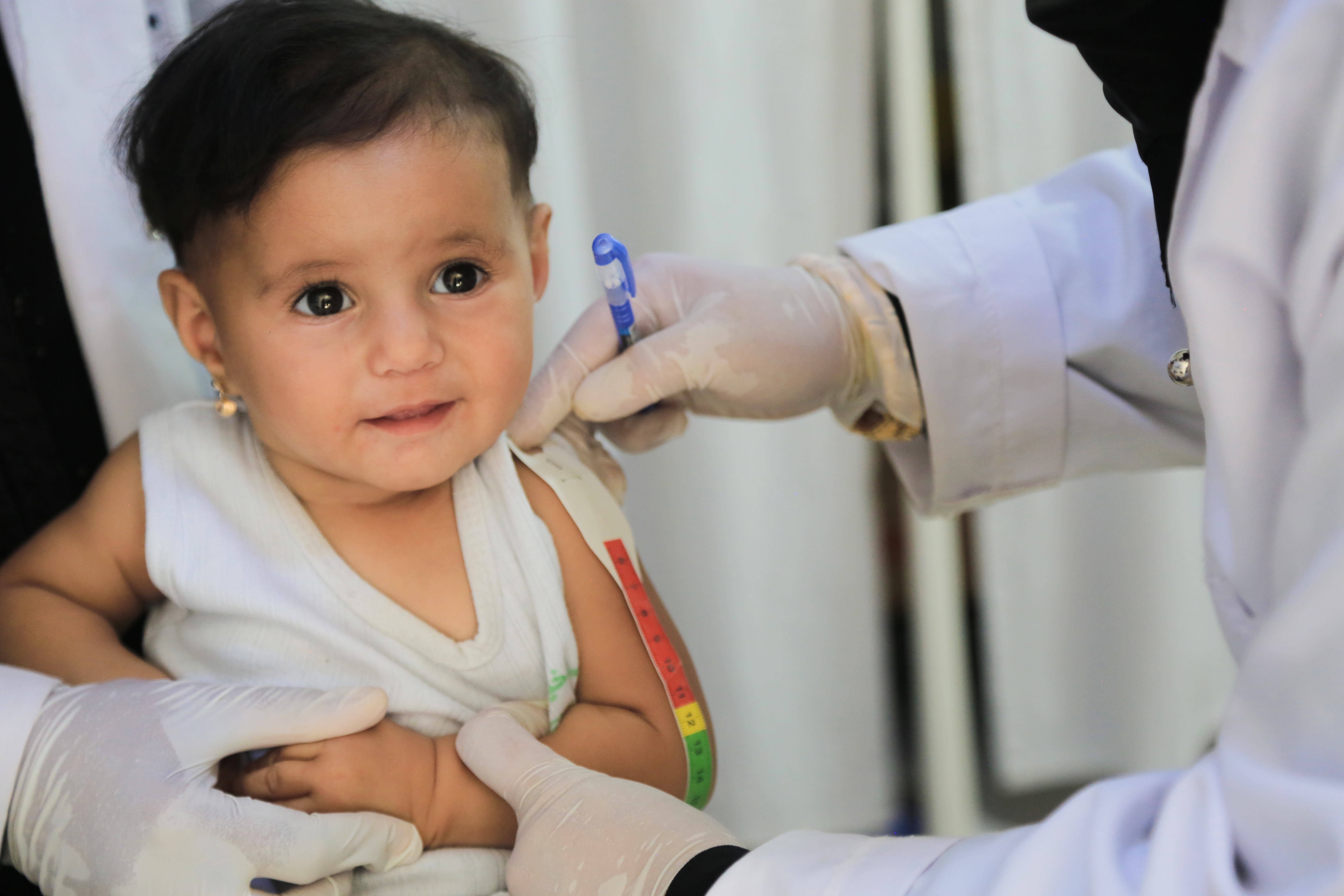
O evaluare nutrițională adecvată include un istoric alimentar detaliat, un examen fizic, măsurători antropometrice (inclusiv greutatea, lungimea și circumferința craniului la copiii mai mici) utilizând standarde de referință adecvate, cum ar fi graficele de creștere standard ale OMS [22] și indici de laborator de bază, dacă este posibil. În plus, măsurătorile grosimii pliurilor cutanate și ale circumferinței brațului mijlociu (MUAC) reprezintă o metodă utilă pentru evaluarea compoziției corporale [23]. Întrebările privind orele de masă, aportul alimentar și dificultățile în timpul alimentației ar trebui să facă parte din istoricul alimentar de rutină și să ofere o impresie calitativă rapidă asupra aportului nutrițional. Pentru o evaluare mai cantitativă, trebuie realizat un istoric alimentar detaliat prin înregistrarea unui jurnal alimentar sau (mai rar) a unui aport alimentar cântărit. Aceasta se efectuează de obicei în asociere cu un dietetician expert. Atunci când se analizează dacă aportul este suficient, valorile de referință alimentare oferă estimări ale gamei de cerințe energetice și nutrienți la grupuri de indivizi [24]. Măsurarea și înregistrarea precisă a greutății și înălțimii (lungimea la copiii < 85 cm sau care nu pot sta în picioare) sunt esențiale pentru identificarea malnutriției. Examinarea clinică fără reprezentarea grafică a măsurătorilor antropometrice pe curbe de creștere s-a dovedit a fi foarte inexactă [25].
Pentru sugarii prematuri cu vârsta de până la doi ani, este esențial să se scadă numărul de săptămâni născute prematur din vârsta reală („cronologică”) pentru a obține vârsta „corectată” pentru reprezentarea grafică pe curbe de creștere. Circumferința craniană trebuie măsurată și reprezentată grafic în mod curent la copiii cu vârsta sub doi ani. Circumferința craniană este un indice fiabil al stării nutriționale și al dezvoltării creierului și este asociată cu performanța școlară și capacitatea intelectuală la copiii de vârstă școlară [26]. Efectele pe termen lung ale malnutriției severe la o vârstă fragedă pot duce la întârzierea creșterii circumferinței craniane, a dezvoltării creierului și la scăderea inteligenței și a performanței școlare. Într-un studiu efectuat pe 96 de absolvenți de liceu sănătoși, dreptaci (vârsta medie ± DS 18,0 ± 0,9 ani), născuți la termen, au fost examinate interrelațiile dintre dimensiunea capului și inteligență, învățare, starea nutrițională, dezvoltarea creierului și dimensiunea capului părinților [27]. În acest studiu, circumferința craniană și volumul creierului au fost asociate negativ cu malnutriția în primul an de viață. MUAC a fost sugerat ca indicator indirect pentru greutate, iar circumferința craniană ca indicator indirect pentru înălțime. MUAC variază minim în primii ani de viață. Este simplu și precis și prezice mortalitatea legată de malnutriție cu specificitate și sensibilitate acceptabile [28].
La pacienții cu schimbări de fluide și edeme, MUAC poate fi un indicator mai bun decât raportul greutate-înălțime pentru clasificarea malnutriției acute [28]. Circumferința mușchilor brați (MAMC) poate fi calculată din MUAC și pliul cutanat tricepsial folosind formula MAMC = MUAC−(pliu cutanat tricepsial × 0,314). Pliul cutanat tricepsial singur poate fi un instrument util de screening la copii [29]. Cu toate acestea, acuratețea sa la copiii cu atrofie musculară extinsă poate fi discutabilă [30]. Criteriul standard pentru îngrijire este măsurarea lungimii în decubit dorsal sau culcat pentru sugarii și copiii cu vârsta mai mică de doi ani și a înălțimii în picioare pentru cei cu vârsta peste doi ani. Cu toate acestea, este adesea dificil să se obțină o înălțime în picioare la copiii bolnavi acut, precum și la populațiile care nu se deplasează în mod ambulatoriu (de exemplu, paralizie cerebrală). În astfel de cazuri, există diverse metode disponibile pentru obținerea unor măsurători liniare, cum ar fi tablele portabile de măsurare a lungimii care se pot transforma în stadiometre și, prin urmare, ar putea fi utilizate în mod fezabil pentru a măsura lungimea în poziție culcată la copiii mai mari (de exemplu, o masă de măsurat). În special, dacă lungimea în poziție culcată și înălțimea în picioare sunt obținute pentru aceeași persoană, există o diferență de aproximativ 0,8 cm, înălțimea în picioare fiind mai mică decât lungimea în poziție culcată. Obținerea unei măsurători a lungimii în poziție culcată fără echipament adecvat (de exemplu, o ruletă pe un pat) nu oferă rezultate precise.
Dacă nu este disponibilă o masă de măsurat, se recomandă obținerea unei măsuri alternative de înălțime, cum ar fi deschiderea brațelor, înălțimea genunchilor sau lungimea tibiei. Indicele de masă corporală (IMC) se calculează ca greutatea în kilograme împărțită la pătratul înălțimii în metri și poate fi utilizat pentru a exprima greutatea ajustată în funcție de înălțime. IMC la copii este comparat cu valorile de referință specifice sexului și vârstei.
Investigațiile de laborator pot fi utile în diagnosticarea malnutriției acute primare și sunt esențiale în stabilirea tratamentului în malnutriția secundară [5]. Deoarece starea nutrițională este un predictor independent al prognosticului la copilul bolnav, este obligatorie o atenție strictă la indicatorii deficiențelor de macronutrienți (proteine) și micronutrienți (vitamine sau minerale). Semnele și simptomele deficiențelor nutriționale specifice se suprapun de obicei și apar frecvent deficiențe multiple. Evaluarea rezervelor de proteine viscerale se face de obicei prin măsurarea proteinelor serice, cel mai frecvent albumina, prealbumina
Tratament
Strategiile de gestionare a malnutriției acute depind de tipul de malnutriție, identificarea cauzei acesteia și severitatea acesteia [5].
Malnutriție acută primară
În malnutriția acută moderată primară, se recomandă gestionarea la domiciliu, inclusiv consilierea părinților, cu accent pe continuarea alăptării și alimentația complementară adecvată (intervenții specifice nutriției). În mod ideal, acești copii ar trebui să primească 25 kcal/kg pe zi de energie în plus față de ceea ce primesc colegii lor sănătoși, iar dietele lor ar trebui să conțină alimente de origine animală bogate în acizi grași esențiali și micronutrienți, inclusiv vitamina A, fier și zinc [5,31,32]. Copiii cu malnutriție acută severă, fără complicații, pot fi gestionați în comunitate cu alimente terapeutice gata de utilizare (pastă de arahide, lapte praf, ulei vegetal și un amestec de minerale și vitamine, conform recomandărilor OMS) [33]. Copiii care au fost tratați pentru complicații și au poftă de mâncare pot fi, de asemenea, tratați în spital cu alimente terapeutice gata de utilizare. Complicațiile malnutriției acute severe (de exemplu, diaree severă, hipoglicemie, hipotermie, pneumonie, infecție a tractului urinar, sepsis etc.) necesită spitalizare până când copiii sunt pregătiți să continue tratamentul la domiciliu [5].
Faza de stabilizare a tratamentului pentru complicații include [32]: (i) tratarea hipoglicemiei cu glucoză orală sau intravenoasă dacă copilul este letargic, inconștient sau are convulsii; (ii) tratarea și prevenirea hipotermiei; (iii) tratarea șocului; (iv) tratarea și prevenirea deshidratării (de preferință cu soluția specială de rehidratare pentru malnutriție, ReSoMal, 5 ml/kg greutate corporală, oral sau prin sondă nazogastrică la fiecare 30 de minute în primele 2 ore, apoi la 5-10 ml/kg/oră în ore alternative timp de până la 10 ore); (v) tratarea și prevenirea infecției. Se sugerează amoxicilină orală la 15 mg/kg la fiecare opt ore timp de cinci zile dacă copilul nu are complicații, în timp ce ampicilina la 50 mg/kg i.m./i.v. la fiecare șase ore timp de două zile, urmată de amoxicilină orală timp de cinci zile și gentamicină la 7,5 mg/kg i.m./i.v. o dată pe zi timp de șapte zile în caz de complicații. Dacă starea copilului nu se ameliorează clinic în 48 de ore sau se agravează după 24 de ore, se poate iniția o cefalosporină de generația a treia (adică ceftriaxonă la 50-75 mg/kg i.v. sau i.m. o dată pe zi) cu gentamicină; (vi) începeți hrănirea atentă. Hrănirea trebuie începută cât mai curând posibil după internare cu formula de lapte pentru bebeluși F-75 recomandată de OMS, care conține 75 kcal/100 ml și 0,9 g proteine/100 ml. Frecvența hrănirii este redusă treptat.
Sindromul de realimentare se datorează disponibilității bruște a glucozei, ceea ce duce la inhibarea gluconeogenezei și la o creștere bruscă a nivelului de insulină. Aceasta provoacă un influx intracelular rapid de potasiu, magneziu și fosfat și, prin urmare, niveluri serice scăzute și o contractilitate miocardică slabă [4,34]. Acest sindrom clinic, care se poate manifesta prin transpirație excesivă, slăbiciune musculară, tahicardie și insuficiență cardiacă, poate fi prevenit prin evitarea administrării rapide de carbohidrați, suplimentarea fosfatului și tiaminei în timpul creșterii inițiale a aportului nutrițional și monitorizarea atentă a pacientului pentru modificări ale fosfatului, potasiului și magneziului seric; (vii) atingerea creșterii de recuperare, care începe atunci când aportul energetic este >150 kcal/kg/zi. În contextele în care nu este disponibil un program pentru gestionarea comunitară a malnutriției acute severe cu alimente terapeutice gata de utilizare, se utilizează F-100. Hrănirea este crescută treptat pentru a obține o creștere rapidă în greutate de >10 g/kg/zi. OMS recomandă dieta pe bază de lapte pentru reabilitarea nutrițională F-100, care conține 100 kcal și 2,9 g proteine/100 ml. Malnutriția cronică necesită intervenții sensibile la nutriție, extinse la nivel național sau regional, inclusiv asigurarea securității alimentare a gospodăriilor, a apei potabile, a igienei adecvate, a educației feminine, crearea de mijloace de trai adecvate, a schemelor de protecție socială etc. [5,35]. Monitorizarea creșterii ar trebui implementată la nivel comunitar, unde starea nutrițională a sugarilor și copiilor mici ar trebui evaluată la fiecare una până la trei luni, iar creșterea acestora ar trebui susținută prin consilierea părinților, chiar înainte de apariția malnutriției.
Malnutriție acută secundară
Pentru gestionarea malnutriției acute secundare, este crucial să se identifice boala subiacentă prin anamneză, examinare și investigații de laborator [5]. Alăptarea exclusivă în primele șase luni, împreună cu suplimentarea cu fier, este adecvată pentru sugarii prematuri și cu greutate mică la naștere. Aceștia prezintă risc de enterocolită necrozantă dacă se administrează alimentație enterală agresivă. În cazul bolilor inflamatorii intestinale ușoare sau al bolilor în remisie, se poate sugera o dietă normală. Formulele lichide comerciale, special preparate, sunt utile pentru unii pacienți cu boli inflamatorii intestinale [36]. În cazul bolilor hepatice cronice avansate, dieta poate necesita economisire de proteine pentru prevenirea hiperamonemiei. Trebuie utilizată o combinație de lipide și carbohidrați cu o cantitate minimă de proteine. O altă caracteristică importantă în bolile hepatice cronice este scăderea excreției de săruri biliare în intestinul subțire, care poate provoca malabsorbție a grăsimilor și a vitaminelor liposolubile. Acest lucru poate fi combătut prin utilizarea trigliceridelor cu lanț mediu ca sursă de grăsimi alimentare, deoarece acestea nu depind de sărurile biliare pentru absorbție.
Trebuie utilizate forme hidrosolubile ale vitaminelor, de obicei liposolubile (A, D, E și K). Copiii cu boli renale cronice pot beneficia de proteine cu conținut ridicat de energie, precum și de înaltă calitate, în cantități care nu vor induce sau agrava uremia [5]. Copiii cu cardiopatii congenitale trebuie să primească suficiente resurse de energie și proteine, fără a crește prea mult volumul de lichide. Aceștia au un aport alimentar redus din cauza oboselii, dispneei și infecțiilor pulmonare frecvente. Insuficiența cardiacă și eforturile respiratorii crescute induc o stare hipermetabolică care crește și mai mult cererea de mai mulți nutrienți [5]. Copiii cu cancer, chimioterapie, radiații, intervenții chirurgicale și infecții prezintă adesea cașexie, din cauza factorului de necroză tumorală-α și a metaboliților tumorali. Dieta trebuie modificată pentru a satisface nevoile calorice crescute. Nutriția parenterală poate fi utilizată pentru a îmbunătăți nutriția în caz de toleranță scăzută la volume mari de nutrienți enterali.
Principiile de gestionare a malnutriției severe rezultate din bolile subiacente menționate mai sus sunt similare cu cele pentru malnutriția acută severă primară.
Gestionarea malnutriției acute în crizele umanitare
În crizele umanitare, alimentația suplimentară este considerată principala strategie pentru prevenirea și tratarea malnutriției acute moderate. Conform ghidurilor Sphere [37], pot fi implementate două tipuri de programe de alimentație suplimentară: (i) programe generale de alimentație suplimentară pentru prevenirea și (ii) programe specifice de alimentație suplimentară pentru tratarea malnutriției acute moderate și prevenirea malnutriției acute severe. Utilizarea fiecăruia depinde de severitatea malnutriției acute, de grupurile de populație vulnerabile și de riscul unei creșteri a malnutriției acute.
Programele generale de alimentație suplimentară sunt recomandate acolo unde siguranța alimentară este scăzută și există necesitatea extinderii intervențiilor dincolo de cazurile de malnutriție acută moderată. Acestea ar trebui să fie însoțite de distribuții generale de alimente care vizează gospodăriile afectate. Nu există indicatori de impact definiți pentru programele generale de alimentație suplimentară, dar este important să se verifice acoperirea, aderența, acceptabilitatea și rațiile furnizate.
Indicatorii pentru gestionarea malnutriției acute moderate se referă în principal la alimentația suplimentară specifică. Scopul principal al unui program de alimentație suplimentară specific este de a preveni ca persoanele moderat malnutrite să devină grav malnutrite și de a le reabilita. Aceste tipuri de programe oferă de obicei un supliment alimentar la rația generală pentru persoanele cu malnutriție moderată, pentru femeile însărcinate și care alăptează, precum și pentru alte persoane cu risc. În concluzie, malnutriția acută este o deficiență nutrițională rezultată fie dintr-un aport inadecvat de energie, fie din proteine, cu prezentare clinică variabilă. Examinarea clinică și măsurarea atentă a stării de creștere, precum și referirea la graficele standard de creștere, sunt esențiale pentru a identifica copiii cu malnutriție acută. Majoritatea copiilor cu malnutriție acută primară pot fi tratați acasă, în timp ce cei cu malnutriție acută severă și complicații necesită tratament în spital; cei fără complicații pot fi tratați acasă cu alimente terapeutice gata de utilizare. Gestionarea malnutriției secundare se bazează în principal pe tratarea cauzei subiacente (malabsorbție, infecții etc.).
Articol preluat: https://www.mdpi.com/2072-6643/12/8/2413
Contribuțiile autorilor
V.D., U.C. și C.R. au contribuit în mod egal la manuscris. Toți autorii au citit și au fost de acord cu versiunea publicată a manuscrisului.
Această cercetare nu a primit finanțare externă.
Autorii declară că nu au niciun conflict de interese.
References
Olsen, E.M.; Peterson, J.; Skovgaard, J.M.; Weile, B.; Jorgensen, T.; Wright, C.M. Failure to thrive: The prevalence and concurrence of anthropometric criteria in a general infant population. Arch. Dis. Child. 2007, 92, 109–114. [Google Scholar] [CrossRef] [PubMed]
Joosten, K.F.; Hulst, J.M. Prevalence of malnutrition in pediatric hospital patients. Curr. Opin. Pediatr. 2008, 20, 590–596. [Google Scholar] [CrossRef]
Mehta, N.M.; Corkins, M.R.; Lyman, B.; Malone, A.; Goday, P.S.; Carney, L.N.; Monczka, J.L.; Plogsted, S.W.; Schwenk, W.F. Defining pediatric malnutrition: A paradigm shift toward etiology-related definitions. JPEN J. Parenter. Enteral. Nutr. 2013, 37, 460–481. [Google Scholar] [CrossRef] [Green Version]
Grover, Z.; Ee, L.C. Protein energy malnutrition. Pediatr. Clin. N. Am. 2009, 56, 1055–1068. [Google Scholar] [CrossRef]
Koletzko, B. Pediatric Nutrition in Practice; World Review Nutrition Dietetics: Basel, Karger, 2015; Volume 113, pp. 139–146. [Google Scholar] [CrossRef]
Ahmed, T.; Michaelsen, K.F.; Frem, J.C.; Tumvine, J. Malnutrition: Report of the FISPGHAN Working Group. J. Pediatr. Gastroenterol. Nutr. 2012, 55, 626–631. [Google Scholar] [CrossRef] [PubMed]
De Onis, O.M.; Wijnhoven, T.M.; Onyango, A.W. Worldwide practices in child growth monitoring. J. Pediatr.2004, 144, 461–465. [Google Scholar] [CrossRef]
Black, R.E.; Victora, C.G.; Walker, S.P.; Bhutta, Z.A.; Christian, P.; de Onis, M.; Ezzati, M.; Grantham-McGregor, S.; Katz, J.; Martorell, R.; et al. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet 2013, 382, 427–451. [Google Scholar] [CrossRef]
UNICEF. Improving Child Nutrition: The Achievable Imperative for Global Progress; UNICEF: New York, NY, USA, 2013. [Google Scholar]
De Onis, M.; Blossner, M.; Borghi, E.; Frongillo, E.A.; Morris, R. Estimates of global prevalence of childhood underweight in 1990 and 2015. JAMA 2004, 291, 2600–2606. [Google Scholar] [CrossRef] [PubMed] [Green Version]
Pawellek, I.; Dokoupil, K.; Koletzko, B. Prevalence of malnutrition in paediatric hospital patients. Clin. Nutr.2008, 27, 72–76. [Google Scholar] [CrossRef] [PubMed]
Secker, D.J.; Jeejeebhoy, K.N. Subjective global nutritional assessment for children. Am. J. Clin. Nutr. 2007, 85, 1083–1089. [Google Scholar] [CrossRef] [Green Version]
Chowdhury, M.S.I.; Akhter, N.; Haque, M.; Aziz, R.; Nahar, N. Serum total protein and albumin levels in different grades of protein energy malnutrition. Bangladesh Soc. Physiol. 2008, 3, 58–60. [Google Scholar] [CrossRef]
Ferdous, T.; Kabir, Z.N.; Wahlin, Å.; Streatfield, K.; Cederholm, T. The multidimensional background of malnutrition among rural older individuals in Bangladesh–a challenge for the Millennium Development Goal. Public Health Nutr. 2009, 12, 2270–2278. [Google Scholar] [CrossRef] [PubMed] [Green Version]
Batool, R.; Butt, M.S.; Sultan, M.T.; Saeed, F.; Naz, R. Protein–energy malnutrition: A risk factor for various ailments. Crit. Rev. Food Sci. Nutr. 2015, 55, 242–253. [Google Scholar] [CrossRef] [PubMed]
Fischer Walker, C.L.; Lamberti, L.; Adair, L.; Guerrant, R.L.; Lescano, A.G.; Martorell, R.; Pinkerton, R.C.; Black, R.E. Does Childhood Diarrhea Influence Cognition Beyond the Diarrhea-Stunting Pathway? PLoS ONE2012, 7, e47908. [Google Scholar] [CrossRef]
Oshikoya, K.A.; Sammons, H.M.; Choonara, I. A systematic review of pharmacokinetics studies in children with protein-energy malnutrition. Eur. J. Clin. Pharm. 2010, 66, 1025–1035. [Google Scholar] [CrossRef] [Green Version]
Mamoun, N.; Homedia, S.; Mabyou, M.; Hussan, M.; Muntasir, A.; Salah, T.; Adam, I. Prevalence, types and risk factors for malnutrition in displaced sudanese children. Am. J. Infect. Dis. 2005, 1, 84–86. [Google Scholar] [CrossRef]
Georgieff, M.K. Nutrition and the developing brain: Nutrient priorities and measurement. Am. J. Clin. Nutr.2007, 85, 614S–620S. [Google Scholar]
Edhborg, M.; Seimyr, L.; Lundh, W.; Widstrom, A.M. Fussy child difficult parenthood? Comparisons between families with a ‘depressed’ mother and non-depressed mother 2 months postpartum. J. Repro. Infant. Psychol.2000, 18, 225–238. [Google Scholar] [CrossRef] [Green Version]
Dicko, M.H.; Gruppen, H.; Traor’e, A.S.; Voragen, A.G.J.; Berkel, W.J.V. Sorghum grain as human food in Africa: Relevance of content of starch and amylase activities. Afr. J. Biotech. 2006, 5, 384–395. [Google Scholar]
Wright, C.M. The use and interpretation of growth charts. Curr. Paediatr. 2002, 12, 279–282. [Google Scholar] [CrossRef]
Brook, C. Determination of body composition of children from skinfold measurements. Arch. Dis. Child. 1971, 46, 182–184. [Google Scholar] [CrossRef] [PubMed] [Green Version]
British Nutrition Foundation. Nutrient Requirements. Available online: www.nutrition.org.uk/nutritionscience/nutrients/nutrient-requirements (accessed on 12 August 2020).
Cross, J.H.; Holden, C.; MacDonald, A.; Pearmain, G.; Stevens, M.C.; Booth, I.W. Clinical examination compared with anthropometry in evaluating nutritional status. Arch. Dis. Child. 1995, 72, 60–61. [Google Scholar] [CrossRef] [PubMed] [Green Version]
Ivanovic, D.M.; Leiva, B.P.; Perez, H.T.; Inzunza, N.B.; Almagià, A.F.; Toro, T.D.; Urrutia, M.S.; Cervilla, J.O.; Bosch, E.O. Long-term effects of severe undernutrition during the first year of life on brain development and learning in Chilean high-school graduates. Nutrients 2000, 16, 1056–1063. [Google Scholar] [CrossRef]
Ivanovic, D.M.; Leiva, B.P.; Pérez, H.T.; Olivares, M.G.; Dìaz, N.S.; Urrutia, M.S.; Almagià, A.F.; Toro, T.D.; Miller, P.T.; Bosch, E.O.; et al. Head size and intelligence, learning, nutritional status and brain development. Neuropsychology 2004, 42, 1118–1131. [Google Scholar] [CrossRef] [Green Version]
Myatt, M.; Khara, T.; Collins, S. A review of methods to detect cases of severely malnourished children in the community for their admission into community-based therapeutic care programs. Food. Nutr. Bull. 2006, 27, S7–S23. [Google Scholar] [CrossRef] [Green Version]
Samson-Fang, L.J.; Stevenson, R.D. Identification of malnutrition in children with cerebral palsy: Poor performance of weight-for-height centiles. Dev. Med. Child. Neurol. 2000, 42, 162–168. [Google Scholar] [CrossRef]
Kong, C.K.; Wong, H.S. Weight-for-height values and limb anthropometric composition of tube-fed children with quadriplegic cerebral palsy. Pediatrics 2005, 116, e839–e845. [Google Scholar] [CrossRef] [Green Version]
Bhutta, Z.A.; Das, J.K.; Rizvi, A.; Gaffey, M.F.; Walker, N.; Horton, S.; Webb, P.; Lartey, A.; Black, R.E. Lancet Nutrition Interventions Review Group; Maternal and Child Nutrition Study Group: Evidence-based interventions for improvement of maternal and child nutrition: What can be done and at what cost? Lancet2013, 382, 452–477. [Google Scholar] [CrossRef]
WHO. Guideline: Updates on the Management of Severe Acute Malnutrition in Infants and Children; WHO: Geneva, Switzerland, 2013. [Google Scholar]
WHO. Report of Second Nutrition Guidance Expert Advisory Group (NUGAG) Meeting of the Subgroup of Nutrition in the Life Course and Undernutrition –Area Acute Malnutrition; WHO: Geneva, Switzerland, 2011. [Google Scholar]
Bhutta, Z.A.; Ahmed, T.; Black, R.E.; Cousens, S.; Dewey, K.; Giugliani, E.; Haider, B.A.; Kirkwood, B.; Morris, S.S.; Sachdev, H.P.S.; et al. What works? Interventions for maternal and child undernutrition and survival. Lancet 2008, 371, 417–440. [Google Scholar] [CrossRef]
Stanga, Z.; Brunner, A.; Leuenberger, M.; Grimble, R.F.; Shenkin, A.; Allison, S.P.; Lobo, D.N. Nutrition in clinical practice—the refeeding syndrome: Illustrative cases and guidelines for prevention and treatment. Eur. J. Clin. Nutr. 2008, 62, 687–694. [Google Scholar] [CrossRef] [Green Version]
Pigneur, B.; Lepage, P.; Mondot, S.; Schmitz, J.; Goulet, O.; Doré, J.; Ruemmele, F.M. Mucosal healing and bacterial composition in response to enteral nutrition vs steroid-based induction therapy-a randomised prospective clinical trial in children with Crohn’s disease. J. Crohns. Colitis. 2019, 13, 846–855. [Google Scholar] [CrossRef] [PubMed] [Green Version]
Sphere Association. The Sphere Handbook: Humanitarian Charter and Minimum Standards in Humanitarian Response, 4th ed.; Practical Action Pub: Geneva, Switzerland, 2018; Available online: www.spherestandards.org/handbook (accessed on 12 August 2020).
© 2020 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).
